近日,天津经开区企业天津中新科炬生物制药股份有限公司(以下简称科炬生物)自主研发的HIV(1+2)三线抗体快检试剂盒(人类免疫缺陷病毒(1+2)三线分型快速检测试剂盒)成功通过欧盟《体外诊断医疗器械法规》(VDR, (EU) 2017/746)认证,斩获CE IVDR CLASS D证书。
该产品成为中国首个获得欧盟IVDR最高风险等级认证的HIV三线产品,填补了国内HIV三线诊断产品在欧盟最高级别认证领域的空白。
欧盟IVDR法规于2017年5月正式发布,全面强化了对体外诊断器械的监管要求。与原有的IVDD(《关于体内诊断医疗器械的指令》)相比,IVDR采用基于风险的A、B、C、D四类分级,其中D类为最高风险级别。HIV检测试剂作为关键公共卫生产品,被明确划分为D类,其认证过程对临床证据、技术文档和质量管理体系均提出极高要求。此外,在IVDR法规框架下,需由公告机构(NB)介入审核的产品比例从IVDD时期的10%—20%大幅提升至80%—90%,行业合规门槛显著提高。
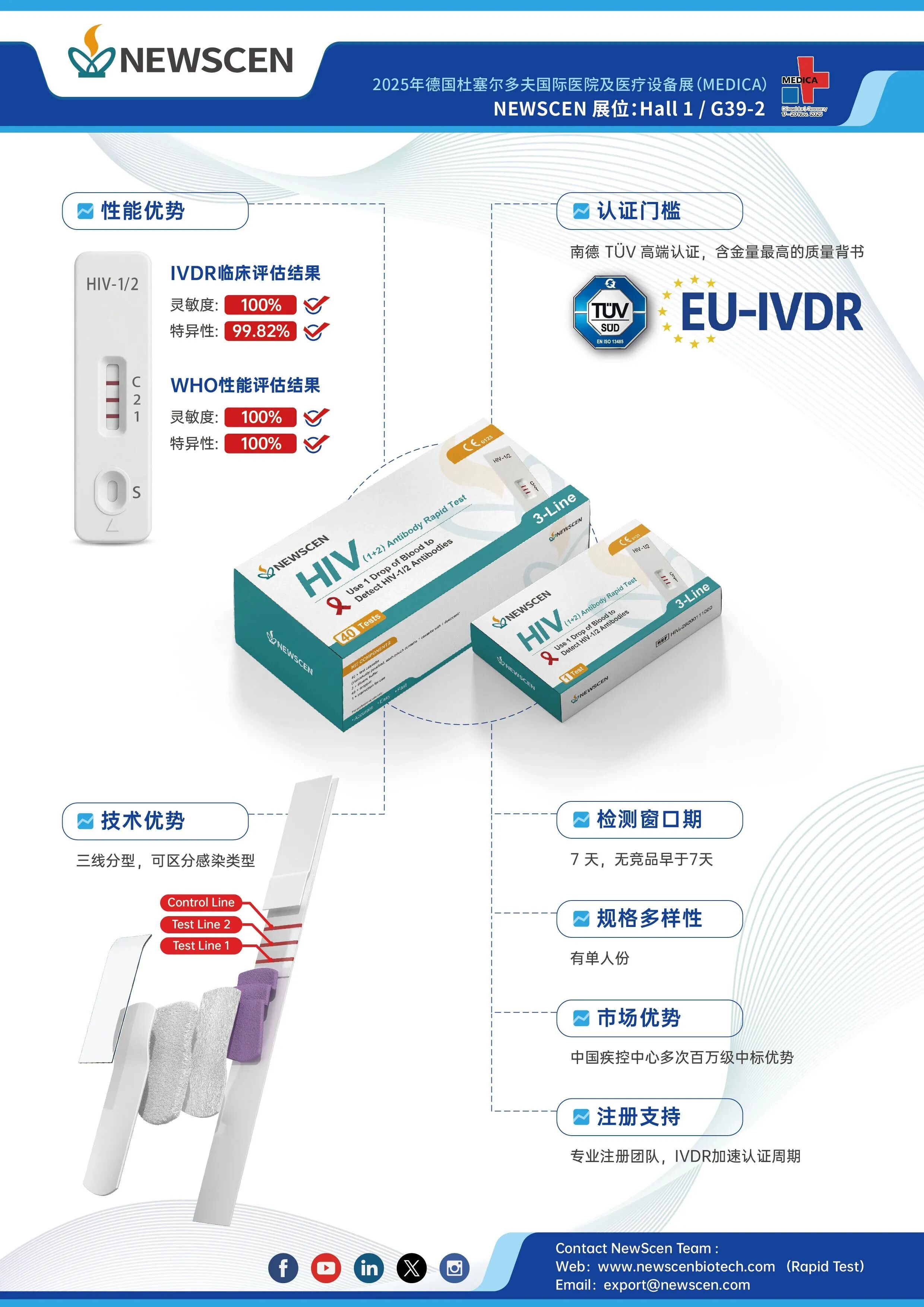
科炬生物HIV(1+2)产品为三线分型产品,在包装设计方面具有显著优势,通过将HIV-1和HIV-2抗原分别独立包被于NC膜的两条检测线上,有助于抗原表位充分暴露,从而提高抗体捕获效率,增强检测灵敏度,实现I型与II型感染的精准区分。
在性能表现方面,据欧盟指定实验室比利时QARAD bvba提供的血清转化盘测试结果显示,该产品最早可在感染后第7天检出抗体,目前尚无同类产品早于该窗口期,且阳性检出数量显著优于同类快检产品。世界卫生组织(WHO)性能评估数据显示,其灵敏度与特异性均达到100%;IVDR临床评估结果显示灵敏度为100%,特异性为99.82%。
除性能卓越外,该产品还具备良好的成本优势与应用灵活性。科炬生物特别推出1人份规格,便于在基层医疗机构中开展高危人群筛查,进一步提升检测可及性。
从市场前景来看,科炬生物此次获证正契合欧盟体外诊断市场对高质量HIV和HCV检测试剂持续增长的需求。据统计,2024年HIV和HCV快检试剂在欧盟体外诊断市场占有率已达30%—35%,预计未来五年复合年增长率为3.44%,具备广阔的市场发展空间。随着IVDR法规全面实施,未获认证产品将逐步退出市场,科炬生物凭借首张IVDR CLASS D证书的先发优势,有望快速提升在欧盟体外诊断市场的占有率,进一步提升全球竞争地位。
此次获证不仅是科炬生物发展的重要里程碑,更是中国体外诊断产业迈向高端化、国际化的重要一步。目前,科炬生物正面向全球招募合作伙伴,以优质的HIV三线诊断产品为纽带,共同开拓全球市场,为提升全球公共卫生安全贡献更多中国力量。
天津中新科炬生物制药股份有限公司
天津中新科炬生物制药股份有限公司于2003年5月在天津经开区成立,于2017年12月新三板挂牌上市,是中国早期的POCT生产企业之一。科炬生物是天津医药集团业务架构中器械诊断板块的重要组成部分,主要专注于体外诊断快速检测领域的技术创新与产业升级。
目前,科炬生物已形成了基层POCT+精准POCT+MI-POCT系统的“一体两翼”式发展平台,产品涵盖心脑血管、传染病、炎症类、激素类、肾损伤、肿瘤等多个领域,曾获评国家高新技术企业、天津市科技型中小企业、天津中小企业100强、天津市A级放心医疗器械生产企业。













